原发性硬化性胆管炎(PSC)是一种免疫介导的胆汁淤积性肝病,目前尚无有效药物治疗,约有70%的PSC患者同时罹患炎症性肠病(IBD),提示肠肝共病。目前,已有大量研究证实,TH17细胞及其分泌的IL-17A是PSC和IBD共同的关键致病因素:患者体内TH17比例升高,可转分化为更具破坏力的“TH17”,从而加剧肠黏膜屏障损伤与炎症。24-去甲熊去氧胆酸(NorUDCA)是一种已进入III期临床的新型胆汁酸,已在PSC患者中显示改善胆汁淤积的疗效;在之前的研究中,发现NorUDCA可以通过抑制mTORC1信号重塑CD8⁺T细胞代谢。考虑到mTORC1也是TH17分化与功能的核心调控节点,作者推测NorUDCA可能具有调节TH17致病性并缓解肠道炎症的潜力。基于此,来自维也纳医科大学等单位的研究人员在Gut期刊上发表了一篇题为“24-Nor-ursodeoxycholic acid improves intestinal inflammation by targeting TH17 pathogenicity and transdifferentiation”的研究论文,围绕“NorUDCA通过调控TH17细胞致病性及转分化改善肠道炎症”的核心命题,采用“体内模型验证→机制解析→转化验证”的技术路线,系统探究了NorUDCA的作用及分子机制。

技术路线图
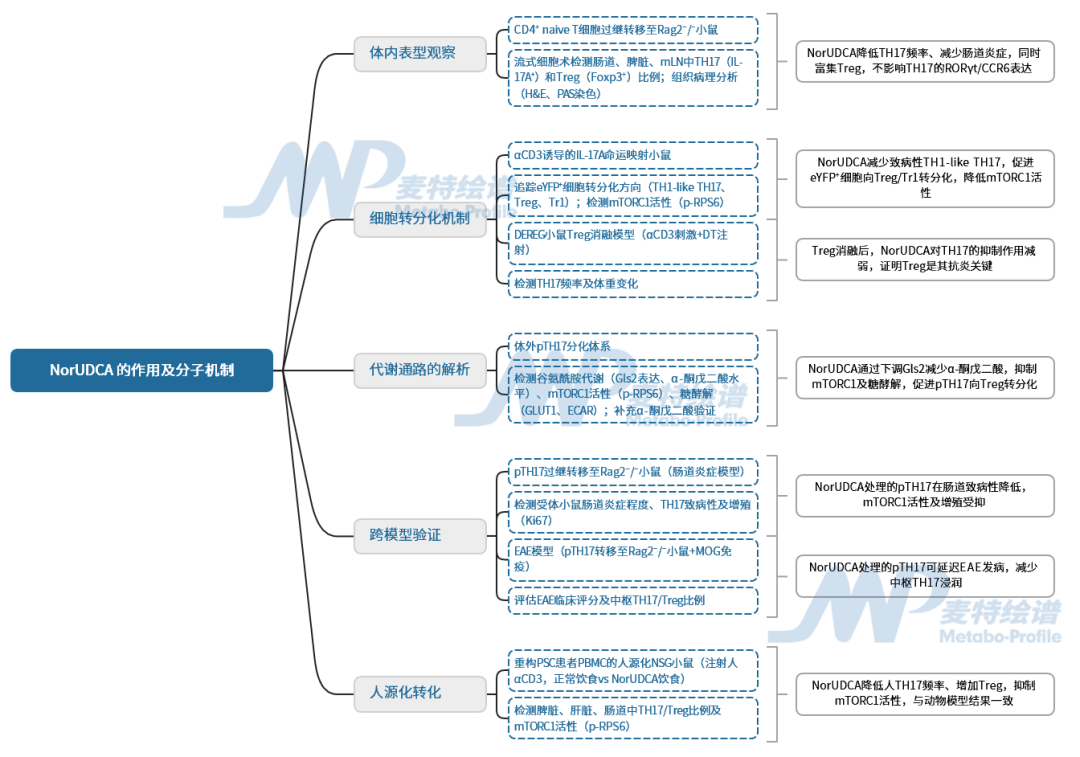
研究结果
1、体内表型观察
体内表型观察通过CD4+初始T细胞过继转移模型开展。研究将CD4+初始T细胞转移到Rag2⁻/⁻小鼠,分“标准饲料组”和“0.5% NorUDCA”饲料组,8周后做检测。检测结果显示,NorUDCA组的血清胆汁酸升高,mLN、脾脏缩小,结肠更长;肠道白细胞浸润减少,结构和黏液屏障保留;肠道及淋巴器官中TH17频率降低、Treg升高,但Treg绝对数不变;TH17的RORγt和CCR6表达未受影响。表明NorUDCA可通过调节TH17和Treg比例减轻肠道炎症,这个过程不影响TH17分化或迁移。
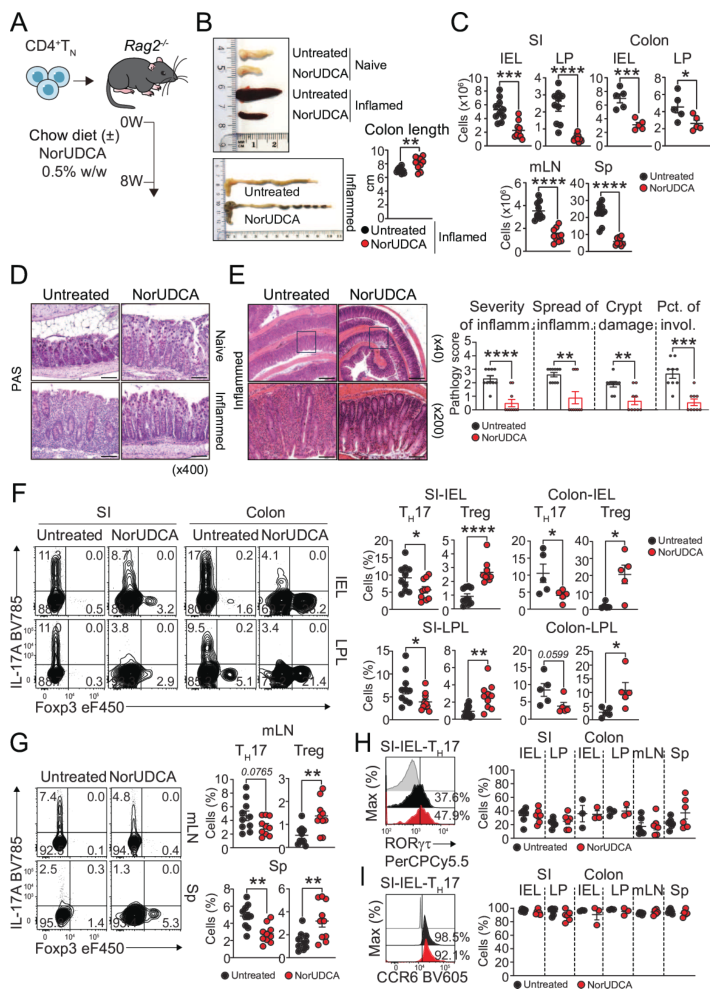
图1. NorUDCA在CD4+初始T细胞过继转移模型中降低多组织TH17频率并富集Treg
2、细胞转分化机制研究
细胞转分化部分通过两个模型探究NorUDCA对TH17细胞命运的调控。首先是αCD3诱导的IL-17A命运映射小鼠模型(IL-17ACreR26R-eYFP),腹腔注射αCD3后,小鼠分食“标准饲料”或“NorUDCA饲料”,100小时后检测。检测结果显示,NorUDCA减轻肠道水肿和淋巴细胞浸润,降低效应TH17(IL-17A+eYFP+)及总eYFP+细胞频率,减少致病性TH1样TH17(IL-17A+IFN-γ+)生成,同时提高Tr1细胞(CD49b+Lag3+)和Treg比例,eYFP+细胞IL-10表达增加。且NorUDCA诱导的Treg源自exTH17细胞和未表达IL-17A的CD4+T细胞,eYFP+细胞mTORC1活性(p-RPS6)受抑。
另一个是DEREG小鼠Treg消融模型,αCD3刺激后注射白喉毒素耗竭Treg,发现NorUDCA对TH17的抑制作用减弱,体重丢失更严重。综上,NorUDCA可抑制TH17向致病性表型转分化,促进其向抗炎性Treg/Tr1转化,且Treg诱导是其抗炎的关键机制。
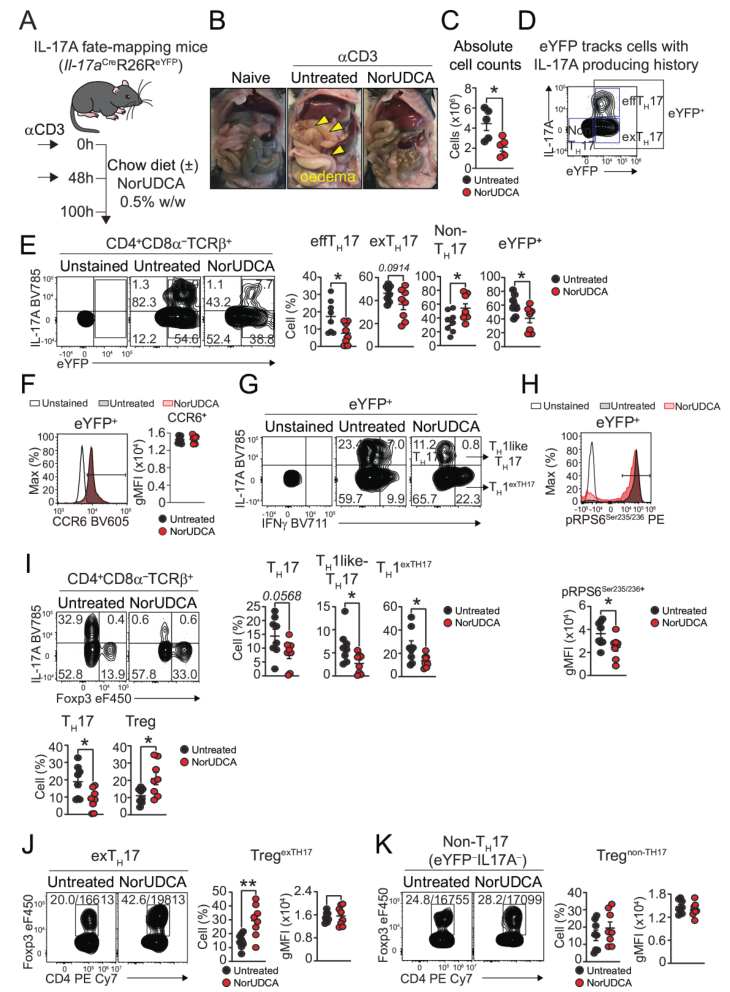
图2. 在αCD3模型中,NorUDCA靶向体内TH17致病性及转分化
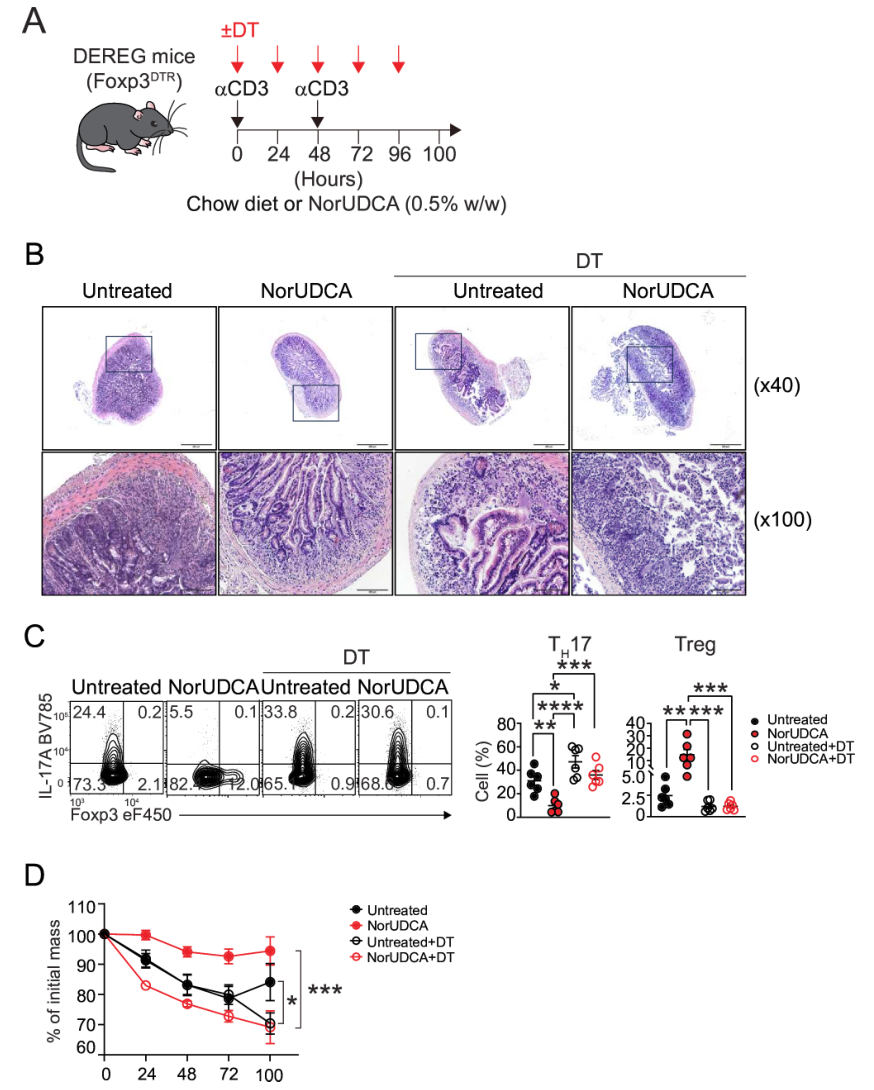
图3. Treg诱导是NorUDCA在体内限制TH17致病性的关键
3、代谢通路解析
代谢通路解析部分以体外致病性TH17(pTH17)分化体系为核心模型,深入探究NorUDCA通过代谢调控影响细胞命运的分子机制。实验以小鼠CD4+初始T细胞为起始材料,在体外诱导其分化为pTH17细胞,设置NorUDCA处理组与对照组,结合多组学、靶向代谢组学、代谢物检测及功能验证实验展开分析。
结果显示,NorUDCA主要通过靶向“谷氨酰胺-mTORC1-糖酵解”轴调控细胞命运:其一,抑制谷氨酰胺代谢,下调谷氨酰胺酶Gls2的表达,减少谷氨酰胺向谷氨酸的转化及α-酮戊二酸的生成,而谷氨酰胺转运体ASCT2的表达未受影响,说明其主要作用于代谢过程而非摄取环节;其二,抑制mTORC1活性,通过降低下游靶蛋白磷酸化RPS6的水平,减弱该信号通路的激活;其三,抑制糖酵解,下调糖酵解关键调控因子Hif1α和c-Myc,减少葡萄糖转运体GLUT1的表达,降低葡萄糖摄取能力(通过2-NBDG荧光标记检测),并降低细胞外酸化率(ECAR),表明糖酵解活性受抑。
同时,NorUDCA可促进pTH17向功能性Treg转化,短期处理即可减少pTH17的IL-17A分泌,提高Foxp3+Treg的比例,且这些Treg能有效抑制pTH17的增殖。补充细胞可通透的α-酮戊二酸可逆转上述效应,恢复mTORC1活性、GLUT1表达及IL-17A分泌,进一步证实谷氨酰胺-mTORC1-糖酵解轴是NorUDCA调控pTH17与Treg细胞命运平衡的关键靶点。
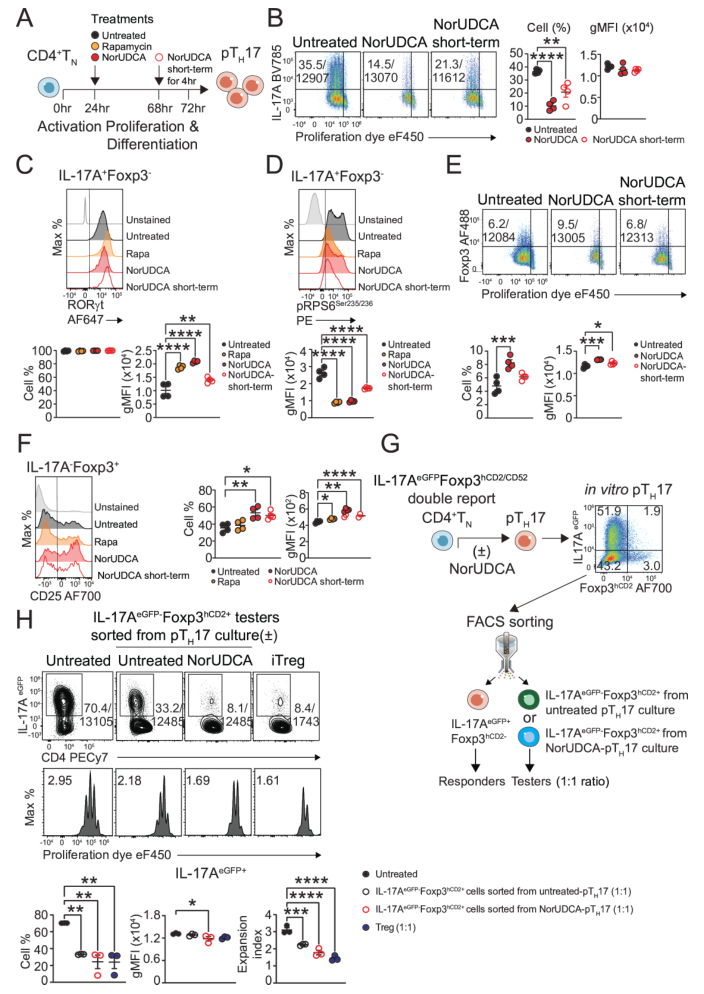
图4. NorUDCA在体外抑制致病性TH17分化并促进功能性抑制性Treg生成
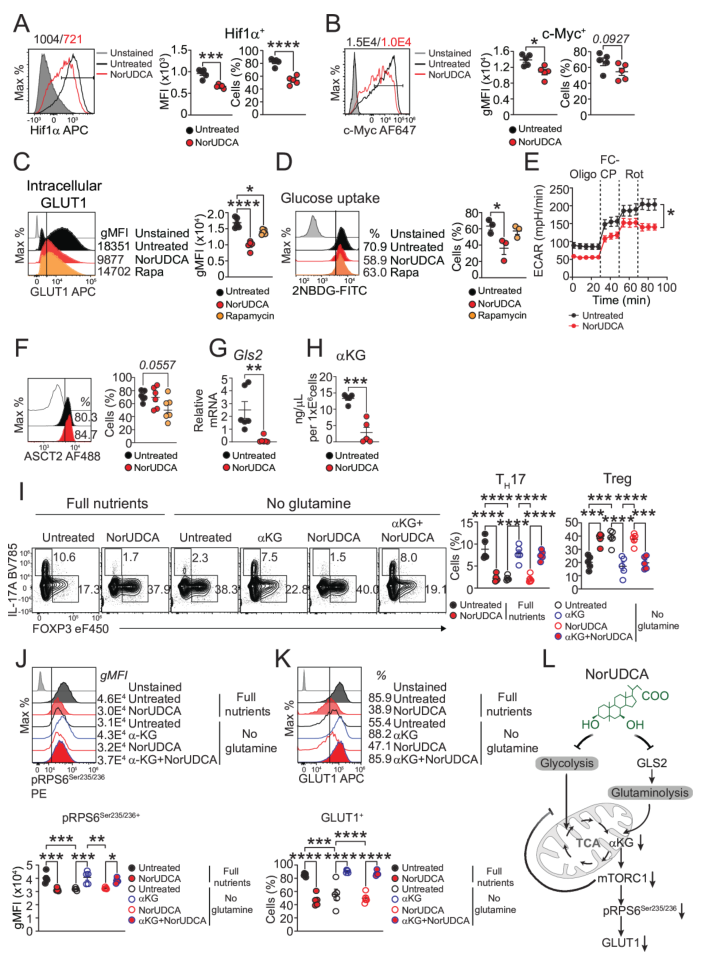
图5. NorUDCA通过限制谷氨酰胺代谢抑制pTH17细胞中mTORC1激活及糖酵解
4、跨模型验证
跨模型验证通过两种过继转移模型验证NorUDCA对致病性TH17(pTH17)的调控作用。首先是肠道炎症模型:将体外诱导的pTH17经NorUDCA短期处理后,转移至Rag2⁻/⁻小鼠,4周后发现,处理组小鼠肠道水肿减轻,肠道上皮内TH17频率降低、Treg频率升高,且TH17的mTORC1活性(p-RPS6)和增殖能力(Ki67)受抑,CCR6表达未变(排除迁移影响)。
其次是实验性自身免疫性脑脊髓炎(EAE)模型:将TCR2D2pTH17经NorUDCA处理后转移至Rag2⁻/⁻小鼠并诱导EAE,结果显示处理组疾病发作延迟、症状减轻,中枢神经系统中TH17减少、Treg增加,TH17的Ki67表达降低,迁移标志物CCR6、CXCR3未受影响。综上,NorUDCA短期处理可通过T细胞内在机制,长期抑制pTH17在肠道及中枢的致病性,为其跨组织抗炎作用提供依据。
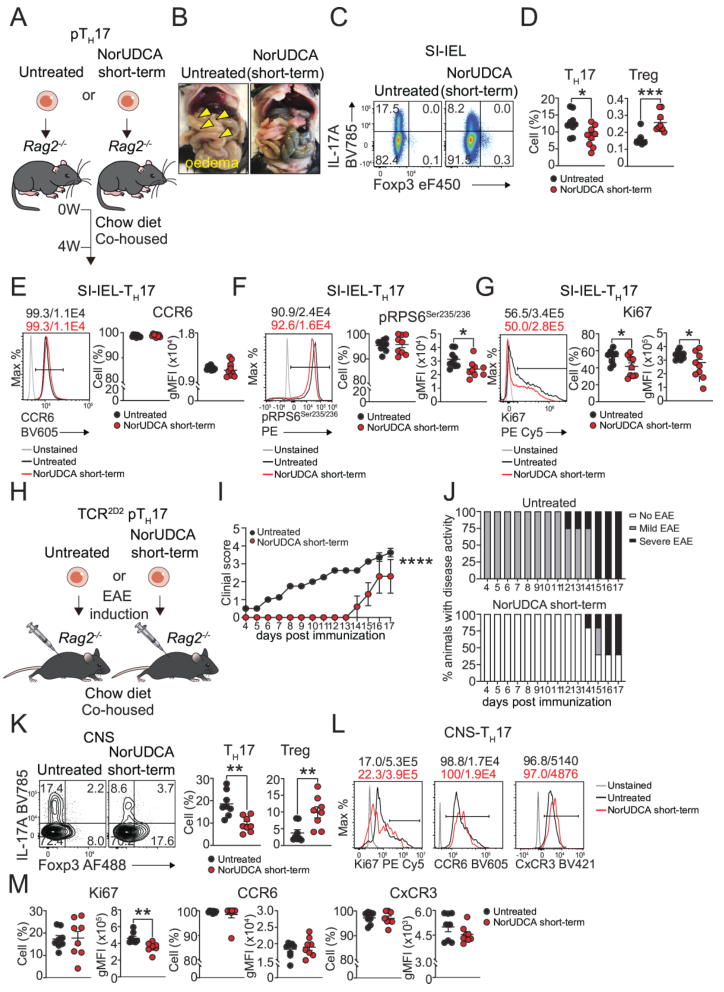
图6. 经NorUDCA短期处理的pTH17细胞在体内转移后致病性及增殖能力降低
5、人源化转化
人源化转化研究采用重构PSC患者PBMC的人源化NSG小鼠模型。小鼠接受人αCD3抗体刺激后,分食“标准饲料”或“NorUDCA饲料”。结果显示,NorUDCA组肠道水肿减轻,脾脏、肝脏及肠道的免疫细胞浸润减少。流式检测发现,其脾脏、肝脏、小肠和结肠中TH17频率降低,Treg频率升高,且TH17的mTORC1活性(p-RPS6)和增殖能力(Ki67)受抑。该结果与动物模型一致,证实NorUDCA可抑制人TH17炎症,为临床应用提供依据。
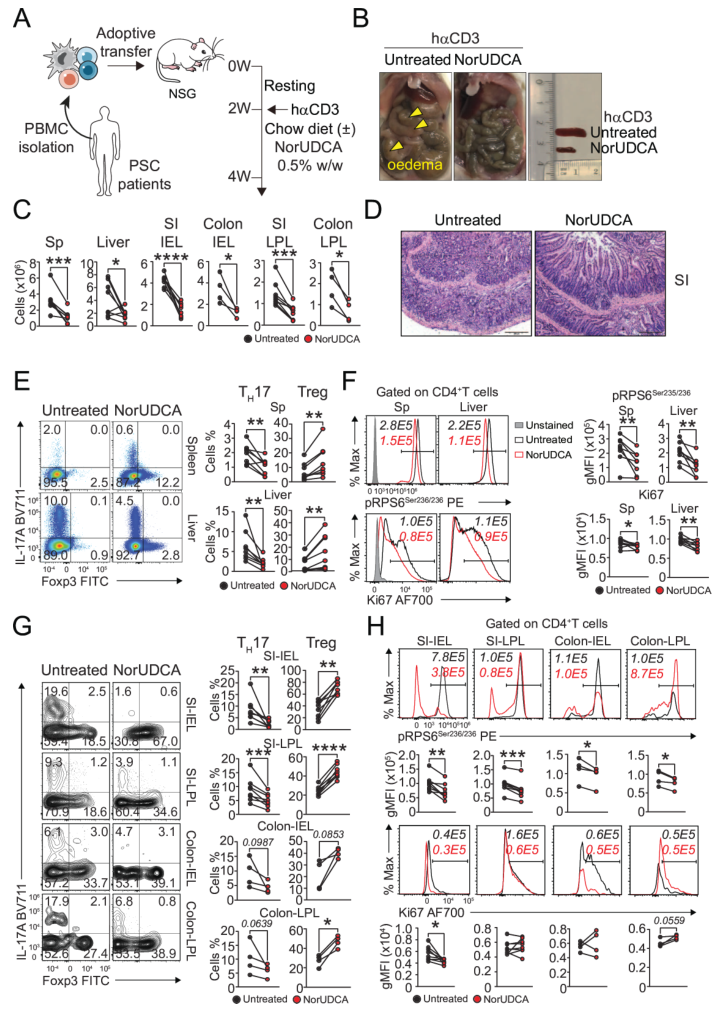
图7. 在重构PSC患者PBMC的人源化NSG模型中,NorUDCA抑制TH17炎症
研究结论
本研究成功搭建起小鼠实验与临床应用的桥梁,证实了 NorUDCA 能够纠正原发性硬化性胆管炎(PSC)患者胆管细胞中存在的系统性 T 细胞相关异常。虽然NorUDCA 早已在部分肝病治疗中崭露头角,此次研究更让我们看到它的新可能 —— 未来或许能为 PSC 相关肠道炎症的治疗开辟全新方向。
参考文献
24-Nor-ursodeoxycholic acid improves intestinal inflammation by targeting TH17 pathogenicity and transdifferentiation. Gut. 2025
绘谱帮你测
经历了千百年的相持后,我们终于看到了战胜贫困的曙光。胜利在向我们招手,更加美好的未来需要我们共同创造。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章600+篇,累计影响因子6000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等权威期刊。
